Що таке пептидний зв'язок і серповидно-клітинна анемія
Опубликованно 22.05.2019 17:25
Тип амідній зв'язку, яка виникає в процесі утворення білків пептидів після взаємодій двох амінокислот, це і є відповіддю на питання, що таке пептидний зв'язок.
З пари амінокислот з'являється дипептид, тобто ланцюг з цих амінокислот, плюс молекула води. За такою ж системою відбувається генерація ланцюжків достовірніше з амінокислот у рибосом, тобто поліпептидів і білків. Властивості ланцюжка
Різні амінокислоти, що є свого роду "будівельним матеріалом" для білка, мають радикал R.
Як і з будь-якими амідами, пептидний зв'язок ланцюга білка C-N з допомогою взаємодії канонічних структур між карбонільним вуглецем і азотним атомом, як правило, має властивість подвійний. Зазвичай це знаходить вияв у зниженні її довжини до 1,33 ангстрема.
Все це веде до наступним висновків: C, H, O, N - 4 зв'язкових атома, плюс 2 a-вуглецю розташовуються на одній площині. Групи R амінокислот і a-вуглецеві водні розташовуються вже за межами цієї зони. Н О в пептидного зв'язку амінокислот і a-вуглеці пари амінокислот є транс-орієнтованими, хоча транс-ізомер більш стабільний. У L-амінокислот R-групи теж є транс-орієнтованими, що присутня у всіх пептидах і білках в природі. Обертання навколо ланцюжка C-N складно, більш імовірно обертання у зв'язку C-C.
Для того щоб зрозуміти, що таке пептидний зв'язок, а також для виявлення самих пептидів з білками і визначення їх кількості в певному розчині, користуються биуретовой реакцією. Розташування атомів
З'єднання в пептидах білків коротше, ніж в інших пептидних групах, так як вона володіє частковою характеристикою зв'язку подвійний. Враховуючи, що таке пептидний зв'язок, можна зробити висновок про малу її рухливості.
Електронне побудова пептидного зв'язку задає тверду плоску структуру групи пептидів. Площині таких груп розташовуються один до одного під кутом. Зв'язок між атомом a-вуглецю і групами a-карбоксильної і a-аміногрупою може провертатися по своїй осі вільно, при тому, що обмежена розміром і характером радикалів, а це дає можливість для поліпептидного ланцюжка задавати собі різні налаштування.
Пептидні зв'язки в білках, як правило, знаходяться в транс-конфігурації, тобто розташування атомів a-вуглецю розміщується в різних частинах групи. Результатом є розташування бічних радикалів у амінокислот на більш віддаленій відстані у просторі один від одного. Розрив білків
Вивчаючи, що таке пептидний зв'язок, зазвичай враховують її міцність. Такі ланцюжки не розриваються самі по собі при нормальних умовах всередині клітини. Тобто при відповідній температурі тіла та нейтральному середовищі.
В умовах лабораторії гідроліз білкових пептидних ланцюжків вивчають в запаяних ампулах, всередині яких знаходиться концентрована соляна кислота, при температурі понад ста п'яти градусів за Цельсієм. Повністю білковий гідроліз до стану вільних амінокислот відбувається приблизно за 24 години.
До питання про те, що таке пептидний зв'язок всередині живих організмів, то в них розрив відбувається за участю певних ферментів-протеолитов. Щоб відшукати в розчині пептиди і білки, а також дізнатися їх кількість, користуються позитивним результатом речовин, які містять у собі дві або більше пептидні зв'язки, тобто биуретовую реакцію. Заміна амінокислоти
Всередині аномального гемоглобіну S мутували 2 ?-ланцюга, глутамат в яких, а також негативно заряджена высокополярная амінокислота в шостому положенні, були підмінені містить радикал гідрофобним валіном.
Всередині мутованого гемоглобіну знаходиться ділянка, яка є компліментарним іншої ділянки з такими ж молекулами, що містить змінену амінокислоту. В кінцевому підсумку молекули гемоглобіну "злиплися разом" і утворили довгі фібрилярні агрегати, які змінюють еритроцит і ведуть до появи мутіруючої еритроцита серповидної форми.
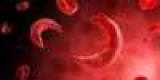
Всередині оксигемоглобіну S в результаті зміни конформації білкової маскується компліментарний ділянку. Відсутність доступу до нього не дає можливості для з'єднання молекул один з одним у цього оксигемоглобіну. Існують умови, що сприяють утворенню HbS агрегатів. Вони збільшують скупчення дезоксигемоглобина всередині клітин. До них можуть належати: гіпоксія; високогірні умови; фізична праця; політ на літаку. Серповидно-клітинна анемія
Оскільки еритроцити у вигляді "серпів" мають низьку прохідність крізь капіляри тканин, вони можуть перекрити собою судини і, таким чином, створити місцеву гіпоксію. Це збільшить скупчення дезоксигемоглобина S всередині еритроцитів, а також швидкість, з якою з'являються агрегати S-гемоглобіну і створюють ще більші умови для еритроцитної деформації.
Серповидно-клітинна анемія - це рецесивне захворювання гомозигот, яке виникає тільки в ситуації, коли обидва батьки передають пару мутують генів ?-ланцюгів. Після того, як дитина народиться, захворювання не проявить себе рівно до тієї пори, поки великі кількості HbF не зміняться на HbS. У хворих виявляється клінічна симптоматика, яка характерна для анемії, тобто: біль голови і запаморочення, часте серцебиття, задишка, слабкість до інфекцій і так далі.
Олексій Кудряшев
Категория: Новости


